تثبیت فاز تتراگونال دیاکسید زیرکونیوم
همانطور که در مقاله ویژگیهای ساختاری اکسید زیرکونیوم بیان شد، ,دیاکسید زیرکونیوم دارای سه پلیمورفیسم مونوکلینیک، تتراگونال و مکعبی است. تبدیل فاز تتراگونال زیرکونیا به مونوکلینیک، از اهمیت خاصی برخوردار است، زیرا بر اثر سردکردن و تبدیل فاز تتراگونال به مونوکلینیک، تغییر حجم زیادی در ساختار ایجاد میشود. این تغییر حجم به اندازهای زیاد است که از حد الاستیسیته ماده تجاوز کرده و منجر به شکست میشود و به صورت ترک پدیدار میگردد. به همین دلیل استفاده از دیاکسید زیرکونیوم خالص در تولید قطعات، امکانپذیر نیست. افزودن اکسیدهای پایدارکننده با ساختار مکعبی مانند Y2O3، CaO، MgO، Sc2O3، CeO2 و غیره، پایداری ساختارهای کریستالی مکعبی و تتراگونال زیرکونیا را تا دمای بالا امکانپذیر میسازد. عواملی نظیر حلالیت یون حلشونده در محلول جامد اکسید زیرکونیوم و اندازه مناسب شعاع اتمی عناصر پایدارکننده، دو فاکتور مهم برای تثبیت فازهای تتراگونال و مکعبی هستند. تعداد زیادی از یونها در جدول تناوبی وجود دارند که شعاع اتمی مناسبی دارند اما به دلیل وجود شرایط نامناسب دیگر مانند عدم حلالیت جامد، فشار بخار بالا وغیره، تنها به تعدادی از عناصر خاکی کمیاب محدود میشوند. پس از پایدارشدن دیاکسید زیرکونیوم، انبساط حرارتی این ماده مانند سایر سرامیکهای تکفاز صورت میگیرد و میتوان از آن برای ساخت قطعات سرامیکی استفاده کرد.
قابل ذکر است که هدف از پایدارسازی دیاکسید زیرکونیوم، کنترل دقیق تبدیل فاز تتراگونال به مونوکلینیک و بهویژه کاهش دمای تبدیل فوق و ایجاد فازهای تتراگونال و مکعبی در درجه حرارتهای پایین و نگهداری در دمای اتاق و همچنین کمک به زینترینگ فاز مکعبی در درجه حرارتهای متوسط است. در تبدیل فاز مونوکلینیک به تتراگونال، ساختار کریستالی منظمتری ایجاد میشود. دانسیته ساختار کریستالی مکعبی دیاکسید زیرکونیوم بیشتر از تتراگونال و تتراگونال بیشتر از مونوکلینیک است.
تثبیت زیرکونیا را میتوان با افزودن کاتیونهای بزرگتر به منظور ایجاد تنش برای گسترش شبکه یا با دوپینگ با کاتیون با ظرفیت پایینتر برای ایجاد جای خالی آنیون اکسیژن یا ترکیبی از این دو، بهدست آورد. جای خالی اکسیژن ایجادشده، میانگین عدد همسایگی را کاهش داده و رسیدن به تقارن مکعبی را آسانتر میکند، این مکانیزم را میتوان موثرتر از گسترش شبکه در نظر گرفت. به عنوان مثال در دیاکسید زیرکونیوم پایدارشده با اکسید کلسیم (CaO)، انرژی واکنش تشکیل جای خالی اکسیژن 88/0 الکترون ولت است، در حالی که انرژی لازم جهت حضور کاتیون بیننشین 05/10 الکترون ولت تخمین زده شده است. لذا عامل اصلی پایدارسازی فاز مکعبی تشکیل جای خالی آنیون است و کاتیونهای پایدارکننده اکسیدی معمولا به صورت جانشینی در مکان کاتیونی شبکه وارد میشوند. اگر اکسید پایدارکننده به مقدار کافی اضافه نشود، آنگاه به جای نوع کاملا پایدارشده(FSZ)، دیاکسید زیرکونیوم جزئی پایدار شده(PSZ) تولید خواهد شد]1[.
یکی از عوامل دیگر برای پایداری فاز زیرکونیا، اثر اندازه ذره است. گزارش شده است که اگر اندازه ذره از 30 نانومترکوچکتر شود، فاز تتراگونال پایدار خواهد شد که این پایداری، به انرژی آزاد سطح نسبت داده شده است. این تاثیر اندازه ذره به دلیل تسلط کشش سطحی (انرژی سطحی) در کنترل مورفولوژی و ساختار کریستالی است. به هر حال، با حرارتدادن دیاکسید زیرکونیوم در دمای بالای 800 درجه سانتیگراد، ساختار آن از تتراگونال به مونوکلینیک تغییر خواهد کرد.
دستهبندی کاتیونهای پایدارکننده دیاکسید زیرکونیوم
کاتیونهای چهار ظرفیتی
چون کاتیونهای چهار ظرفیتی فاز مکعبی را از طریق ایجاد تنش در شبکه پایدار میکنند، درنتیجه اندازه پایدارکنندهها باید از کاتیون Zr4+ با شعاع 84/0 آنگستروم بزرگتر باشد. در عمل، استفاده از این پایدارکنندهها به دو فاکتور قیمت و مقدار سمیبودن آنها بستگی دارد. این فاکتورها انتخاب را به کاتیون Ce4+ با شعاع 97/0 آنگستروم محدود میکند و بهطور معمول کسر مولی بالایی از CeO2 برای تثبیت فاز مکعبی باید به دیاکسید زیرکونیوم اضافه شود. برای پایدارکردن فاز تتراگونال به 30 درصد مولی CeO2 نیاز است.
کاتیونهای سه ظرفیتی نادر خاکی
کاتیونهای سه ظرفیتی نادر خاکی، براساس ایجاد جای خالی اکسیژن بر طبق واکنش زیر ساختار مکعبی دیاکسید زیرکونیوم را پایدار میکنند:
R2O3 + 2 Zr × Zr’ + 1/2 O2 → 2R’Zr + Vo•• + 2 ZrO2
میزان حلالیت کاتیونهای سه ظرفیتی در زیرکونیا، به تطابق شعاع یونی کاتیون و همچنین شباهت شبکههای فرعی کاتیون و آنیون اکسیژن بین ساختار سیسکوئیاکسید مکعبی R2O3 بستگی دارد. از این رو، Y2O3 و تعدادی از اکسیدهای نادر خاکی در این گروه قرار میگیرند. در بین تمام پایدارکنندهها، Y3+ بهترین گزینه جهت پایدارکردن دیاکسید زیرکونیوم برای کاربرد در دمای بالا است.
عناصر قلیایی دو ظرفیتی
واکنش کاتیونهای دو ظرفیتی با دیاکسید زیرکونیوم به منظور پایدارسازی ساختار مکعبی در زیر آورده شده است:
MO + 2 Zr× Zr + Oo× → 2M“Zr + Vo•• + ZrO2
در فرمول بالا، کاتیونهای دو ظرفیتی نسبت به کاتیونهای سه ظرفیتی، در ساخت جاهای خالی آنیون دوبرابر کارآمدتر هستند. به هر حال، این کاتیونها توانایی ایجاد یک ساختار کاملا پایدار را ندارند. این گروه کاتیونها، فقط برای ساخت زیرکونیای جزئی پایدارشده استفاده میشود.
فلزات انتقالی و Al3+
تعدادی از فلزات واسطه ردیف اول M3+ در دیاکسید زیرکونیوم دوپ شدهاند. همچنین گونههای +2 و +4 نیز مورد بررسی قرار گرفتهاند. برای مثال، مقدار کم Mn3+ اضافهشده به زیرکونیای جزئی پایدارشده با ایتریا، توانایی تغییر فاز تتراگونال به فاز مکعبی را دارد. بر اساس تحقیقات گذشته، Al3+، Fe3+، Cu2+ و Ni2+ زیرکونیا را پایدار میکند، اما در عملیات حرارتی بالاتر از 800 درجه سانتیگراد، جدایش فاز رخ داده و در هنگام سردشدن زیرکونیا با فاز مونوکلینیک تشکیل میشود.
اثر ترکیبات فازی بر ساختار دیاکسید زیرکونیوم
تهیه نمودار تعادل فازی دیاکسید زیرکونیوم با سایر سیستمهای اکسیدی به منظور کاربرد زیرکونیا به عنوان یک ماده سرامیکی مهندسی ضروری است. در دمای پایین، جایی که یک فاز دوم اکسیدی میتواند از طریق تغییرات میکروساختاری خواص مورد نظر را تغییر دهد و هم در دمای بالا جایی که کاتیون دومی میتواند تغییرات دینامیک میکروساختار را باعث شود، درک از تعادل فاز زیرکونیا با سایر سیستمهای اکسیدی لازم است.
اکسیدهایی که به میزان قابلتوجهی در زیرکونیا حل شده و به علت شعاع اتمی مناسب خود، باعث پایداری فاز تتراگونال و مکعبی میشوند، بیشترین توجه را به خود جلب کردهاند. Y2O3، CaO، MgO، Sc2O3، CeO2 و دیگر اکسیدهای عناصر نادر خاکی، در این دسته قرار میگیرند.
دیاگرام فازی سیستم ZrO2-Y2O3 در شکل 1 نشان داده شده است. مهمترین خصوصیت دیاگرام فازی ZrO2-Y2O3، کاهش دمای تبدیل تتراگونال به مونوکلینیک با افزایش مقدار ایتریا است. این امر با افزودن MgO یا CaO رخ نمیدهد.
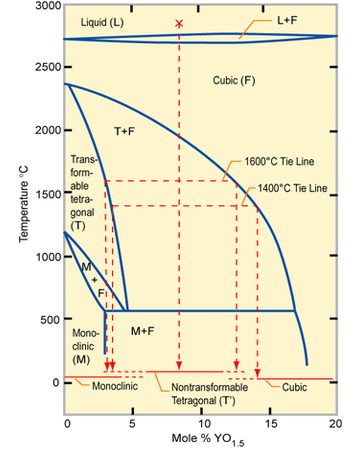
شکل1. دیاگرام فازی سیستم دیاکسید زیرکونیوم-ایتریا(ZrO2-Y2O3).
در بالای زمینه فاز مونوکلینیک و قبل از رسیدن به زمینه فاز تتراگونال قابلتبدیل، یک زمینه فاز مونوکلینیک همراه با تتراگونال وجود دارد. محلول جامد تتراگونال قابلتبدیل، یعنی فازی که طی سردکردن به فاز مونوکلینیک تبدیل خواهد شد که در محدوده ترکیبی 5-0 درصد مولی Y2O3 قرار دارد. برای ترکیباتی که مقادیر بیشتری ایتریا دارند، مخلوطی از محلول جامد تتراگونال و مکعبی وجود دارد. درنهایت افزایش بیشتر ایتریا سبب ایجاد محلول جامد مکعبی همگنی از دیاکسید زیرکونیوم میشود که از دمای اتاق تا نقطه ذوب پایدار است.
دیاگرام فازی ZrO2-Y2O3 نسبت به سیستم ZrO2-MgO و سیستم ZrO2-CaO دارای مزیتهایی در تولید پلیکریستال زیرکونیای تتراگونال(TZP) است. اولین مزیت، محدوده حد حلالیت زیاد ایتریا در زیرکونیای با فاز تتراگونال است، این محدوده شامل 3-2 درصد مولی Y2O3 در محدوده دمایی زینترینگTZP است. در مقابل، حداکثر حلالیت منیزیا در زیرکونیای با فاز تتراگونال، کمتر از یک درصد مولی MgOاست. بنابراین محدوده ارائهشده برای مواد تتراگونال شبهپایدار در سیستم ZrO2-Y2O3 بسیار گستردهتر است. این خاصیت، توانایی انعطافپذیری بالایی را در شرایط تولید به وجود میآورد.
دومین مزیت شامل تجزیه محلولهای جامد تتراگونال و مکعبی در طی سردکردن از دمای زینتر است. این برای Y-TZP مشکل محسوب نمیشود، زیرا دمای یوتکتوئید تقریبا 550 درجه سانتیگراد است. درنتیجه، تجزیه نفوذی محلول جامد مذکور بسیار آهستهتر از آن است که اهمیت داشته باشد. در مقابل، دمای یوتکتوئید سیستم ZrO2-MgO حدود1400 درجه سانتیگراد است. این بدین معنی است که برای Y-TZP در دمای 550 درجه سانتیگراد و کمتر از آن، به دلیل سرعت نفوذ پایین، تبدیل فاز آهسته انجام میشود که این امر مشکلی به وجود نمیآورد ولی برای Mg-PSZ در 1400 درجه سانتیگراد و کمتر از آن، به دلیل سرعت بالای نفوذ، کنترل فاز بسیار سختتر است.
اثر ایتریا بر ساختار میکروسکوپی دیاکسید زیرکونیوم
انتقال فاز تتراگونال به مکعبی زیرکونیا را همچنین میتوان با شباهت شبکه این دو فاز نیز توضیح داد. برای پارامترهای شبکه زیرکونیا، ct (محور c فاز تتراگونال، 5194/0 نانومتر) از ac ( محور c فاز مکعبی، 5116/0 نانومتر) بزرگتر است، در صورتی که at با اندازه 5079/0 نانومتر از ac، کمی کوچکتر میشود. این ثابت میکند که با حلشدن Y2O3، ct محلول جامد تتراگونال زیرکونیا کاهش و at این محلول افزایش مییابد. بنابراین با حلشدن ایتریا، شبکه تتراگونال زیرکونیا به شبکه مکعبی زیرکونیا نزدیکتر میشود. تاثیر مقدار ایتریای حلشده بر روی پارامترهای شبکه تتراکونال و مکعبی در شکل 2 نشان داده شده است.
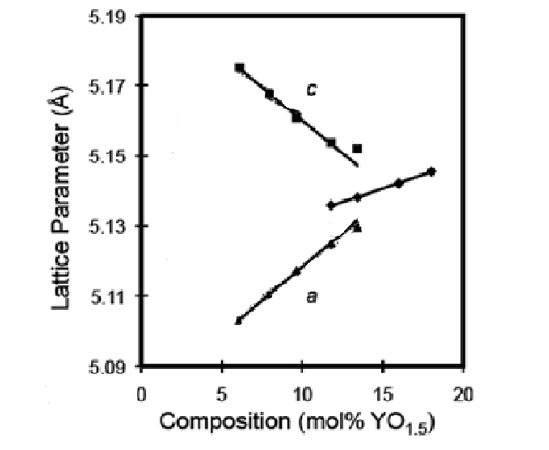
شکل2. تاثیر مقدار ایتریای حلشده بر روی پارامترهای شبکه تتراگونال و مکعبی دیاکسید زیرکونیوم.
مراجع
[1] E. C. Sabbarao, “Zirconia an overview” , J ADV cream, 3, 1-24, 1981.-